こんにちわ。
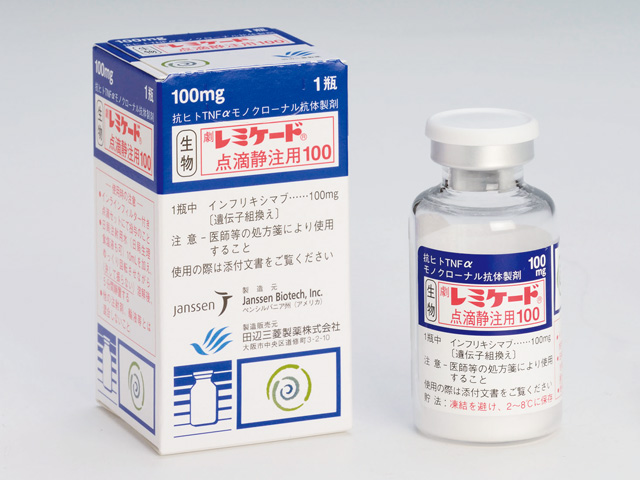
先日、2018年12月10日にファイザー株式会社からレミケード(一般名:インフリキシマブ)のバイオ後発品(バイオシミラー)が発売されました。
先発薬はご存知、UC治療において画期的な成果をもたらした「レミケード」(田辺三菱製薬)です。
そもそもバイオシミラーとはなんでしょうか?
そのあたりも含めて、今日はレミケードのバイオシミラーについてまとめます。
レミケードについてのおさらい
バイオシミラーの話の前に簡単にレミケードの歴史についておさらいです。
レミケードは1998年にセントコア・オーソ・バイオテク(米国)が潰瘍性大腸炎と同じIBDのひとつであるクローン病の治療薬として米国で初めて承認されました。
翌年には関節リウマチへの適応も承認されます。
日本では、2002年にクローン病の治療薬として当時の田辺製薬(現・田辺三菱製薬)より発売されました。
その後、2010年6月に潰瘍性大腸炎への適応が承認されました。
現在は、IBDの2疾患を含め国内での適応症は下記の7つです。
- 関節リウマチ
- クローン病
- 潰瘍性大腸炎
- 乾癬
- ベーチェット病
- 強直性脊椎炎
- 川崎病
これらの適応症に対して、国内では5万人以上、全世界では90カ国以上・125万人以上の患者さんに使用されています。
以上がレミケードの簡単な歴史です。
なお、潰瘍性大腸炎治療におけるレミケードの基本的な情報については、患者向けの以下の資料が参考になります。

参考:潰瘍性大腸炎の治療薬「レミケード」について(指導箋・B5版・小冊子)|田辺三菱製薬
レミケードのバイオシミラーについて
本題です。
まずは、そもそもバイオシミラーとは何か?ということについて見てみましょう。
「バイオシミラー」とは?ジェネリック医薬品との違い
ざっくり言えばいわゆる後発医薬品(ジェネリック医薬品)のバイオ製剤版です。
では、なぜバイオ製剤の場合はジェネリック医薬品ではなく、「バイオシミラー」というちょっとかっこいいネーミングをされているのでしょう?
細かいポイントを知りたい方はこちらのページが参考になりますが、ややこしいので患者目線で重要なポイントだけ抑えておきましょう。
① 一般名処方ができない
1つ目のポイントは一般名処方ができないことです。
もっと正確に言えば、各社の後発品には「インフリキシマブ後続1」といった具合にそれぞれ独自の一般名がつけられており、バイオシミラーを処方する意図で単純な「インフリキシマブ」という一般名処方はできません。
- 一般的名称(一般名)は先行バイオ医薬品の一般名の末尾に「後続1(2、3、…)」を角括弧書きで追加する。
- 販売名は、先行バイオ医薬品の一般名の末尾に、バイオシミラーであることを示すために「BS」と記載し、その後に剤形、含量、会社名(または屋号等)を付ける。
(例)△△製薬が製造販売する、××××××(遺伝子組換え)のバイオ後続品の注射液
| 先行バイオ医薬品 | 一般名 | ××××××(遺伝子組換え) |
|---|---|---|
| バイオシミラー | 一般名 | ○○○○○○(遺伝子組換え)[××××××後続1] |
| 商品名 | ××××××BS注射液 含量 「△△」 |
◎レミケードの場合
- 一般名:【インフリキシマブ後続◯】
- 販売名:【インフリキシマブBS点滴静注用100mg「XX」】
※「XX」は製薬会社名(「NK」、「日医工」、「ファイザー」など
つまり、医師がバイオシミラーを選んだ上で処方しているということです。
従って、薬局においてよく聞かれる「このお薬はジェネリックにできますがどうしますか?」という質問をされることもありません。
先行バイオ医薬品から切り替えて、バイオシミラーを使うことは可能ですが、一連の治療期間内に混用や無意味な切り替えは避ける必要があります。
【参考】一般名・商品名の違い等についてはこちらの記事をどうぞ。
② 薬価
通常のジェネリック薬品が先発品の50%以下に対して、バイオシミラーは先行バイオ医薬品の70%*となっています。
(*先行バイオ医薬品の補正加算の有無により70%未満になる場合がある。)
さらに、ジェネリック医薬品と異なり、臨床試験が必要となるため、10%を上限とした上乗せができる場合があります。
ちなみに先発品のレミケードの薬価が100mg一瓶 80,426円に対して、今回販売されたファイザー製のバイオシミラー(インフリキシマブ後続3)50,042円なので先発品の約6割の価格となっています。
③ 先発品と全く同じではない
先行バイオ医薬品のデータはすべて公開されるわけではないので、後発製薬メーカーは独自で製造方法を確立します。
言ってみればよく似た(同等・同質)の効果・効能を有する製剤と考えるのがいいかと思います。
適応症は先発品を全てカバーしていません。
適応症が外挿される(再審査期間終了後に追加される)ことはあります。
また、製造工程が違うので、添加物も異なります。
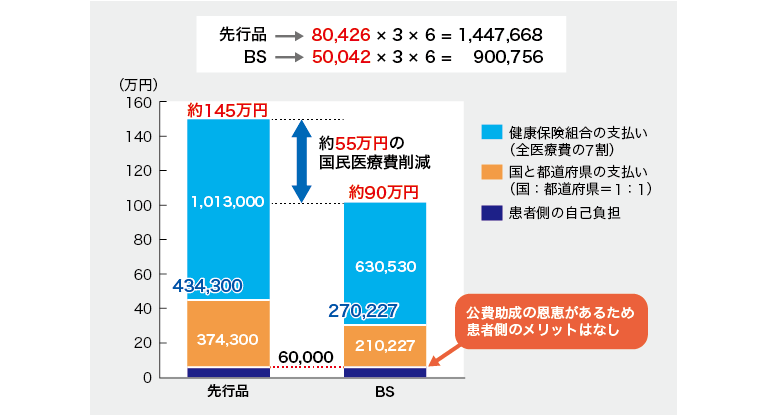
バイオシミラーの医療費削減効果
Medical Tribuneの試算によると、下記の例で年間医療費は約55万円削減されるとのことです。
ただ患者としては、医療費助成制度(軽症高額該当含む)のためメリットと言っていいのかわかりませんが、積極的に変えるモチベーションにはならないかもしれません。※これは最後の結論で考えを述べます。
標準的な所得のUC患者(体重60kgと推定)で8週ごとの寛解維持療法を受けているケースを想定。1回の治療で3バイアル(300mg)、年6回で18バイアル(1,800mg)使用するとして1年間の費用を算出すると、先行品では約145万円、IFX-BSでは約90万円で、医療費は約55万円削減されることになる
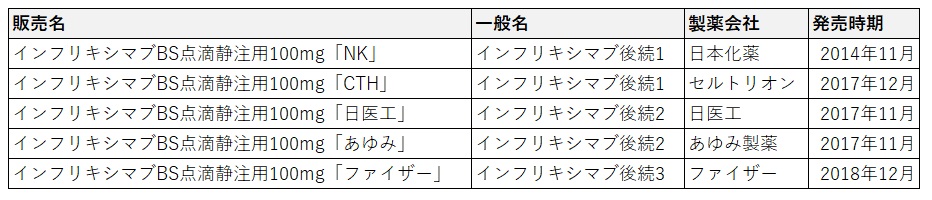
現在のレミケードのバイオシミラーまとめ
2018年12月現在、先発品レミケードのバイオシミラーは国内では3製品、5社から発売されています。
※【インフリキシマブ後続1】は韓国のCelltrion Inc.と日本化薬株式会社の共同開発で製造販売承認を取得し、日本化薬およびセルトリオン・ヘルスケア・ジャパンより販売。
※【インフリキシマブ後続2】は、Aprogen Inc.(本社:韓国デジョン)により創製され、日本において日医工株式会社及びヤクハン製薬株式会社が共同で開発を行った。その後、あゆみ製薬株式会社がヤクハン製薬株式会社より製造販売承認を承継した。
バイオシミラーを使うかどうか
結局患者としてはここが問題ですね。
先発品を使うメリットは、先発品としての信頼感・安心です。
後発品を使うメリットとしては、全体としての医療費の削減です。
ですが、後発品といえどバイオシミラーは高価なので、使用する場合は高額療養費の対象となり患者の自己負担は変わりません。
よって、患者個人として切り替える動機づけとしては乏しいかもしれません。
これから高齢化社会が加速し、ますます医療費の財源は切迫してくるでしょうから、全体最適を考えて積極的にバイオシミラーを取り入れたいという人は素晴らしい考えです。
一方、それを全員に強要することもできません。
先発品と似たような効果・効能はあれど、あくまで全く同じではないのです。
その点を不安に思う患者はもちろん、医者でも処方は慎重とすべきと考える人は多くいます。
結局、僕個人としてはどちらにすべきというべき論はこの選択においては不適切だと思っており、患者個々人として納得して治療を受けることが重要だと思います。
<おわり>





